"Saber comer es saber vivir"
Confucio
La alimentación es una de las funciones básicas o vitales de todo ser vivo. Por medio de los alimentos nos proveemos de todas aquellas sustancias que son necesarias para el correcto funcionamiento del organismo y el desarrollo del resto de funciones vitales. La alimentación es, por tanto, un proceso imprescindible para la vida y esto, aunque pueda parecer una afirmación lógica, es algo que no se entiende totalmente o de lo que se tiene una visión parcial. En el mal llamado mundo desarrollado o primer mundo, la sociedad se ha acostumbrado a una disponibilidad continua de alimentos y la abundancia es la norma, pero lo cierto es que la especie humana se ha desarrollado y evolucionado en un contexto diametralmente opuesto.
La hiperfagia de nuestros días ejerce una serie de efectos sobre nuestro cuerpo que pueden llevar al desarrollo de múltiples enfermedades. Los malos hábitos alimenticios, y no solo en lo que respecta a alimentos saludables o perjudiciales, sino también a las prácticas y conductas anormales, suponen un desequilibrio de muchos sistemas biológicos y constituyen una parte importante en el problema de la obesidad actual y patologías relacionadas.
En la entrada de hoy vamos a comentar los mecanismos con que cuenta el cuerpo humano para la regulación de la alimentación, el hambre y la saciedad; y qué otros factores nos inducen a alimentarnos de la forma en que lo hacemos.
También puedes consultar otras entradas de esta serie:
También puedes consultar otras entradas de esta serie:
Existe un complejo entramado de señales químicas encargadas de regular la ingesta de alimentos y el balance energético. Sería correcto hablar de un auténtico circuito de hambre-saciedad, que integra un gran número de estructuras, hormonas, proteínas, neurotransmisores y otros compuestos cuyo objetivo es conseguir una regulación fina de los ritmos de alimentación en base a las necesidades de nuestro organismo. Aunque la fisiología puede resultar algo compleja, vamos a repasar brevemente los principales protagonistas de este circuito de hambre-saciedad.
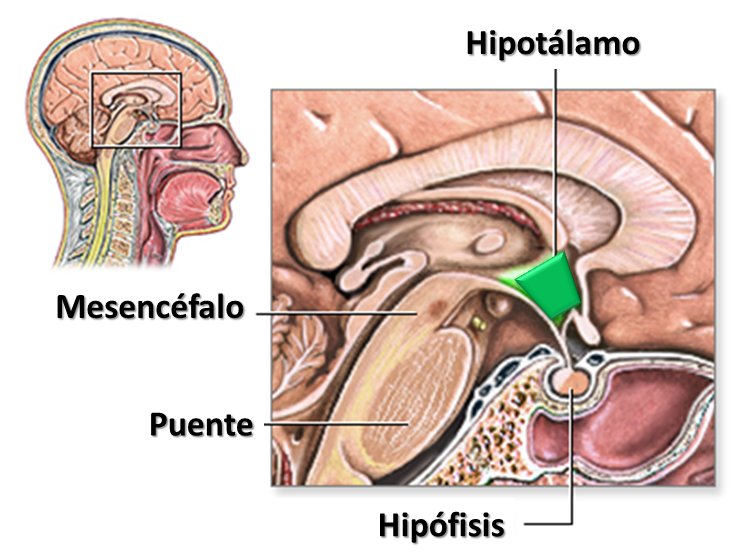
- El hipotálamo, centro del circuito de hambre-saciedad
El hipotálamo es una región cerebral situada inmediatamente por debajo del tálamo y por encima del tronco del encéfalo compuesta por una serie de agrupaciones celulares que constituyen núcleos con un variado número de funciones viscerales y endocrinas, y es el lugar donde se integra la compleja red de vías neuronales que regulan el hambre y la saciedad.
Los núcleos hipotalámicos permanecen en constante comunicación, controlando múltiples funciones corporales mediante la secreción de diversas sustancias y el control de la producción de hormonas. A la hora de hablar del control de la ingesta de alimentos, los principales núcleos que debemos conocer son:
- Núcleos ventromedial y posterolateral: son considerados como el centro de la saciedad.
- Núcleo lateral: constituye el centro del hambre o la alimentación.
- Otros núcleos: arqueado, paraventricular y dorsomedial. Cumplen funciones reguladoras de la ingesta.
En el núcleo arqueado convergen señales del tubo digestivo y el tejido adiposo, que informan del estado nutricional y permiten controlar adecuadamente la ingesta mediante la inducción (efecto orexigénico) o supresión (efecto anorexigénico) del hambre. El núcleo arqueado tiene dos tipos de células:
- Neuronas productoras de NPY y AgRP:
- Regulación a corto plazo de la ingesta de alimentos
Los procesos de regulación del hambre y la saciedad comienzan incluso antes de haber ingerido alimento. Los receptores de los órganos de los sentidos (vista, oído, olfato, gusto y tacto) envían desde el primer momento señales a los núcleos del hipotálamo; incluso en pacientes con fístulas esofágicas (en los que la comida no puede llegar al estómago) se ha visto una inhibición del hambre ante la ingesta de comida.
- Otros núcleos: arqueado, paraventricular y dorsomedial. Cumplen funciones reguladoras de la ingesta.
En el núcleo arqueado convergen señales del tubo digestivo y el tejido adiposo, que informan del estado nutricional y permiten controlar adecuadamente la ingesta mediante la inducción (efecto orexigénico) o supresión (efecto anorexigénico) del hambre. El núcleo arqueado tiene dos tipos de células:
- Neuronas productoras de NPY y AgRP:
- Neuropéptido Y (NPY). Se secreta cuando descienden las reservas energéticas. Estimula el apetito y disminuye la termogénesis.
- Péptido relacionado con Agouti (AgRP). Actúa como antagonista de los receptores MCR-3 y MCR-4. Contribuye a aumentar la ingesta y es considerada la molécula con mayor potencia orexigénica. También disminuye la termogénesis en el tejido graso pardo, fomenta la captación de glucosa por el tejido adiposo y condiciona una ganancia de peso.
- Proopiomelanocortina (POMC). Da lugar, entre otros, a la hormona estimulante de melanocitos alfa (α-MSH), que a través de los receptores melanocortínicos (MCR-3 y MCR-4) del núcleo paraventricular disminuye la ingesta y aumenta gasto energético. Su inhibicción aumenta la ingesta. Se ha comprobado que mutaciones en MCR-4 son causa genética de obesidad.
- Trascrito regulado por cocaína y anfetamina (CART). Fue descrito originalmente al estudiar los efectos de la cocaína y las anfetaminas (de ahí su nombre), sustancias que estimulan su producción. Tiene acciones catabólicas y disminuye la ingesta al inhibir NPY.
- Regulación a corto plazo de la ingesta de alimentos
Los procesos de regulación del hambre y la saciedad comienzan incluso antes de haber ingerido alimento. Los receptores de los órganos de los sentidos (vista, oído, olfato, gusto y tacto) envían desde el primer momento señales a los núcleos del hipotálamo; incluso en pacientes con fístulas esofágicas (en los que la comida no puede llegar al estómago) se ha visto una inhibición del hambre ante la ingesta de comida.
La primera gran señal para regular la ingesta la provoca la distensión del tubo digestivo (estómago y duodeno), que a través del nervio vago envía una señal inhibitoria del hambre. Distintos órganos del tubo digestivo van a producir moléculas en respuesta a la presencia de alimento. Así, por ejemplo, la entrada de grasas en el duodeno provoca la producción de colecistoquinina (CCK) que estimula la contracción de la vesícula, produce inhibición de la motilidad y el vaciamiento gástrico, e induce saciedad a través de la vía melanocortínica. También son de importancia el péptido similar al glucagón (GLP-1), que retrasa el vaciamiento gástrico, induce la secreción de insulina y reduce la de glucagón; o el péptido YY (PYY), que se secreta ante la presencia de grasa en ileon y colon de manera proporcional a las calorías ingeridas.
Pero si hay una molécula de gran importancia que se sintetiza a nivel digestivo ésta es la grelina (a veces escrita ghrelina a semejanza de su nombre en inglés). Producida por las células oxínticas del estómago, es considerada la hormona orexigénica por excelencia. Sus concentraciones aumentan con el ayuno y en los momentos previos a la comida, y descienden tras la ingesta. Pero sus funciones no se limitan únicamente a la regulación a corto plazo, pues se ha visto que cuando una persona adelgaza los niveles de grelina aumentan, incrementándose el deseo de comer; niveles excesivamente elevados podrían estar relacionados con estado de ansiedad y son un factor a tener en cuenta a la hora de llevar a cabo dietas hipocalóricas por tiempo prolongado.
- Regulación a largo plazo de la ingesta de alimentos
Pero si hay una molécula de gran importancia que se sintetiza a nivel digestivo ésta es la grelina (a veces escrita ghrelina a semejanza de su nombre en inglés). Producida por las células oxínticas del estómago, es considerada la hormona orexigénica por excelencia. Sus concentraciones aumentan con el ayuno y en los momentos previos a la comida, y descienden tras la ingesta. Pero sus funciones no se limitan únicamente a la regulación a corto plazo, pues se ha visto que cuando una persona adelgaza los niveles de grelina aumentan, incrementándose el deseo de comer; niveles excesivamente elevados podrían estar relacionados con estado de ansiedad y son un factor a tener en cuenta a la hora de llevar a cabo dietas hipocalóricas por tiempo prolongado.
- Regulación a largo plazo de la ingesta de alimentos
El deseo de ingerir alimentos refleja en un primer término las necesidades energéticas y nutricionales del cuerpo humano. Con el objetivo de mantener un balance energético adecuado, contamos con mecanismos que regulan la ingesta a largo plazo en función de estas necesidades.
Las primeras teorías que buscan explicar la regulación de los mecanismos de hambre y saciedad relacionaron éstas con las concentraciones sanguíneas de determinadas sustancias (glucosa, aminoácidos, cuerpos cetónicos y ácidos grasos). Desde hace ya muchos años se sabe que los descensos de glucemia inducen el hambre y se ha comprobado que los aumentos producen la estimulación de ciertas neuronas en los núcleos ventromedial y paraventricular del hipotálamo, a la vez que reducen la actividad de las neuronas de los núcleos laterales; la insulina a su vez inhibe a los péptidos orexígenos hipotalámicos. Estos mismos efectos se empiezan a ver con respecto a las concentraciones de aminoácidos y algunos lípidos.
El centro de regulación de la temperatura (también situado en hipotálamo) tendría relación con la alimentación, al aumentar el hambre ante descensos prolongados de temperatura. Las hormonas tiroideas y los glucocorticoides también tienen efectos estimuladores del apetito.
El hipotálamo es capaz de conocer en tiempo real las reservas energéticas del organismo a través de la leptina, hormona liberada por los adipocitos. La leptina atraviesa la barrera hematoencefálica, llega al hipotálamo y se une a sus receptores en células productas de POMC y núcleo paraventriculares generando un gran número de respuestas:
- Menor producción de sustancias orexigénicas como NPY y AgRP
- Activación de POMC con producción de α-MSH
- Mayor producción hormona liberadora de corticotropina
- Hiperactividad simpática
- Reducción de la secreción de insulina
Se considera la leptina como el principal regulador de la conducta alimentaria a largo plazo, con influencia en multitud de sistemas hormonales y se ha especulado mucho sobre su papel en la obesidad. Sabemos que una parte importante de pacientes obesos pueden presentar resistencia a la leptina, pero no se ha demostrado que la administración de ésta de forma exógena tenga utilidad a la hora de prevenir o tratar la obesidad en la mayoría de casos. El estudio de la leptina por sí sola es un tema de gran amplitud y complejidad.
En resumen, las principales sustancias implicadas en el control del hambre y la saciedad quedan sintetizadas en la siguiente tabla:
Las primeras teorías que buscan explicar la regulación de los mecanismos de hambre y saciedad relacionaron éstas con las concentraciones sanguíneas de determinadas sustancias (glucosa, aminoácidos, cuerpos cetónicos y ácidos grasos). Desde hace ya muchos años se sabe que los descensos de glucemia inducen el hambre y se ha comprobado que los aumentos producen la estimulación de ciertas neuronas en los núcleos ventromedial y paraventricular del hipotálamo, a la vez que reducen la actividad de las neuronas de los núcleos laterales; la insulina a su vez inhibe a los péptidos orexígenos hipotalámicos. Estos mismos efectos se empiezan a ver con respecto a las concentraciones de aminoácidos y algunos lípidos.
El centro de regulación de la temperatura (también situado en hipotálamo) tendría relación con la alimentación, al aumentar el hambre ante descensos prolongados de temperatura. Las hormonas tiroideas y los glucocorticoides también tienen efectos estimuladores del apetito.
El hipotálamo es capaz de conocer en tiempo real las reservas energéticas del organismo a través de la leptina, hormona liberada por los adipocitos. La leptina atraviesa la barrera hematoencefálica, llega al hipotálamo y se une a sus receptores en células productas de POMC y núcleo paraventriculares generando un gran número de respuestas:
- Menor producción de sustancias orexigénicas como NPY y AgRP
- Activación de POMC con producción de α-MSH
- Mayor producción hormona liberadora de corticotropina
- Hiperactividad simpática
- Reducción de la secreción de insulina
Se considera la leptina como el principal regulador de la conducta alimentaria a largo plazo, con influencia en multitud de sistemas hormonales y se ha especulado mucho sobre su papel en la obesidad. Sabemos que una parte importante de pacientes obesos pueden presentar resistencia a la leptina, pero no se ha demostrado que la administración de ésta de forma exógena tenga utilidad a la hora de prevenir o tratar la obesidad en la mayoría de casos. El estudio de la leptina por sí sola es un tema de gran amplitud y complejidad.
En resumen, las principales sustancias implicadas en el control del hambre y la saciedad quedan sintetizadas en la siguiente tabla:
Papel del balance energético en la regulación del hambre y la saciedad
El fin último de los ritmos de hambre y saciedad es mantener el balance energético, haciendo que el organismo se procure nutrientes y energía en el momento en que los necesite, pero tan importante es impedir la inanición como evitar un consumo excesivo que lleve al sobre-almacenamiento de reservas energéticas.
La falta de alimento se traduce en un déficit energético, el cual debe provocar una cierta respuesta hormonal para ser corregido. Dicha respuesta hormonal, que como hemos dicho debe inducir la ingesta, va dirigida a modificar el funcionamiento del circuito de hambre-saciedad.
La leptina es uno de los mediadores fundamentales en este proceso. Sus niveles en sangre se relacionan proporcionalmente con el volumen de los depósitos grasos, de ahí su importancia en la conducta alimentaria. Además, esta hormona está íntimamente relacionada con otros muchos ejes hormonales, que incluyen las vías para el metabolismo de los carbohidratos y los ácidos grasos, o la síntesis de hormonas tiroideas.
Los aumentos de glucemia provocan un aumento en la secreción de insulina, cuyo objetivo es introducir en las células los carbohidratos presentes para su utilización y/o reserva. Así, la insulina contribuye a la formación de tejido graso, lo que a su vez aumenta la producción de leptina. Se produce un doble estímulo anorexígeno, mediado tanto por la insulina como por la leptina, por lo que bien podríamos decir que leptina e insulina son medidores o señalizadores de las reservas adiposas del organismo, constituyendo una conexión entre el hambre y el balance energético.
La leptina también tiene efectos sobre el metabolismo lipídico, estimulando la síntesis de acetil – coenzima A carboxilasa, enzima necesaria para la síntesis y oxidación de ácidos grasos. De este modo, indica la disponibilidad de ácidos grasos y favorece un estado de utilización de las reservas energéticas.
La influencia de la leptina sobre la síntesis de hormonas tiroideas juega también un papel importante en el gasto energético. Una situación de hambruna prolongada reduce los niveles de leptina y lleva a una menor actividad de la TRH (hormona liberadora de tirotropina), primer eslabón en la síntesis de hormonas tiroideas, rebajando la tasa metabólica basal y la necesidad de energía. Por este motivo, déficits calóricos mantenidos de forma crónica se han relacionado con estancamientos en la pérdida de peso y otras alteraciones metabólicas.
Otra vía sobre la que actúa la leptina es la del AgRP, cuya inhibición reduce la sensación de hambre y facilita la movilización de glucosa y ácidos grasos desde sus depósitos.
Estos y otros muchos mecanismos tienen un objetivo claro: que aparezca hambre como señal de reducción de las reservas energéticas y saciedad como señal de suficiencia de las mismas. Una relación tan aparentemente sencilla está regulada por un gran número de procesos, por lo que pequeños desequilibrios pueden acarrear alteraciones de estos mecanismos, provocando una desconexión entre los ritmos de hambre y saciedad, y el balance energético.
¿Cómo comemos realmente? Aspectos socioculturales de la alimentación
Ya hemos visto los principales sustratos anatómicos y fisiológicos implicados en el control del hambre y la saciedad, y su influencia en la regulación del balance energético. Teniendo en cuenta únicamente estos factores biológicos bien podríamos decir que el hambre estaría determinada por las necesidades energéticas y nutricionales del organismo, sin embargo sabemos que el hambre no viene regida únicamente por factores biológicos y que existe un importante componente social, cultural e incluso psicológico, factores que intervienen en los ritmos de hambre y saciedad, y generan un patrón de alimentación que es único de la especie humana.
- El reloj biológico contra el reloj social
- El reloj biológico contra el reloj social
El ser humano es el único animal que cuenta con la posibilidad de regular sus horarios por medio de un reloj externo. Todas las especies, incluida la humana, cuentan con un auténtico reloj endógeno, una serie de ritmos circadianos de producción de distintas sustancias, algunas de las cuales juegan un papel importante en el circuito de hambre-saciedad. El hambre en sí misma parece presentar un ritmo circadiano a lo largo del día, independiente del horario de sueño, las principales comidas o las calorías consumidas, con un pico de hambre en torno a las 8 de la tarde.
Factores ambientales tan diversos como la luz, la temperatura o el ciclo lunar influyen en estos ritmos y pueden modificarlos pero sin duda alguna el objeto que más actúa en contra o mejor dicho se impone sobre el ritmo circadiano de hambre y saciedad es el reloj. Nos hemos fijado un esquema de comidas obligados por motivos laborales o compromisos sociales, comiendo porque lo dice el reloj y no porque realmente sintamos que necesitamos hacerlo. De este modo, las necesidades energéticas pasan a un segundo plano y dejan de actuar como principal regulador del hambre, con lo que este papel recae en el horario, que no tiene porqué guardar relación con el resto de ritmos biológicos de nuestro cuerpo.
- Disponibilidad de alimentos y "comer por placer"
Frente a los animales que viven en libertad y que dependen de los alimentos que puedan encontrar en su hábitat, los humanos tenemos la posibilidad de elegir qué comer y cuándo hacerlo. La gran disponibilidad de alimentos permite que nos guiemos por otros muchos aspectos a lo hora de seleccionar qué comida pondremos en nuestro plato. Podemos elegir los alimentos en función de lo que hayamos aprendido sobre sus características saludables o perjudiciales, sus propiedades organolépticas, el cocinado y presentación de las receta, nuestra forma física e incluso componentes hereditarios. El día a día de cualquier persona puede convertirse en un auténtico "buffet libre" donde el límite de lo que puedas comer únicamente está en lo que puedas imaginar... o pagar.
Esto hace que podamos permitirnos el lujo de "comer por placer" en lugar de comer porque es necesario. Comer puede convertirse en una afición (y es perfectamente sano disfrutar con la comida), pero se ha demostrado que los circuitos neuronales implicados en el deseo de comer por necesidad son distintos a los circuitos encargados de comer porque deseamos saborear cierta comida con la disfrutamos. Esto no constituiría ningún problema, pues si ambas vías se encuentran separadas anatómica y funcionalmente, podemos desarrollar ambas conductas en función de la situación sin que se produzcan interferencias en ambas. El conflicto surge cuando la vía del placer se impone, bien silenciando la auténtica necesidad de comer o bien provocando que seleccionemos los alimentos únicamente en función de nuestros gustos, y aún siendo conscientes de que una comida en concreto no aporta todo lo que necesitamos preferimos comerla, saciando nuestra hambre "placentera" sin satisfacer nuestra hambre "fisiológica".
- Importancia de la tradición a la hora de alimentarnos
Resulta un hecho indudable que distintas poblaciones presentan hábitos de alimentación muy diferentes entre sí. En algunos casos, las pautas que rigen las dietas de estas poblaciones han sido heredadas de generaciones ancestrales y se mantienen parecidas a ellas en mayor o menor medida. En este sentido juega un papel importante la disponibilidad de alimentos que es propia y característica de cada hábitat, pues resulta lógico pensar que la dieta de nuestros antepasados se diseñara en función de los alimentos más abundantes en el área en cuestión. Las actitudes, creencias y prácticas que subyacen a estos patrones de alimentación pueden estar profundamente arraigados en algunas sociedades y grupos sociales, de modo que la tradición en cuanto a la forma de comer de un cierto colectivo forma parte de sus características distintivas y supone un factor de gran importancia a la hora de determinar cómo un individuo percibe la comida y desarrolla ciertas preferencias hacia algunos alimentos. De este modo, un plato que en un determinado país o región es considerado un manjar en otra región distinta puede ser percibido como algo desagradable y nada apetecible.
- Educación y promoción de hábitos de alimentación saludables
La posible relación entre la alimentación y la enfermedad resulta de gran interés, aunque no siempre se ha prestado a este aspecto la atención que se merece. Hace relativamente poco que se ha empezado a estudiar directamente el rol que determinadas pautas de alimentación pudieran tener en la génesis de distintas patologías, si bien los estudios realizados, a tenor de la situación actual, no parecen estar arrojando resultados de gran utilidad.
La elaboración de guías y recomendaciones de hábitos de vida compatibles con la salud es un objetivo fundamental de los gobiernos y asociaciones sanitarias y sociales, y resulta fundamental que desde pequeños recibamos una educación suficiente para poder seguir aquellas conductas de alimentación que pueden aportarnos beneficios y evitar aquellas que podrían resultar perjudiciales.
Ahora bien, aunque es cierto que de forma global la población ha adquirido ciertas nociones básicas sobre qué alimentos son más saludables y puede identificar aquellos que no lo son tanto, cualquiera puede elegir ignorarlos dejándose guiar por otros aspectos que, sin duda alguna, representan un mayor peso. Por otro lado, no todas las recomendaciones nutricionales actuales son lo efectivas que debieran ser, y muchos aspectos clásicos están actualmente en tela de juicio. Ciertos debates generan confusión y arrojan a la población mensajes contradictorios, no quedando del todo claro cuál es la dieta más saludable o que permita prevenir enfermedades. En consecuencia, la promoción de hábitos de vida saludable pierde poder como factor a tener en cuenta y no va a tener un gran impacto sobre la percepción que tenemos sobre la comida
Dejamos por hoy este tema, que continuaré en la siguiente entrada comentando el papel de los aspectos psicológicos en los ritmos de hambre y saciedad y cómo recuperar los mecanismos que nos permitan alimentarnos de forma saludable.
Bibliografía
Schwartz MW, Woods SC, Porte DJ, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature, 2000; 404(6778):661-671.De Araujo IE, Gutierrez R, Oliveira-Maia AJ, Pereira AJr, Nicolelis MA, Simon SA. Neural ensemble coding of satiety states. Neuron 2006; 51(4): 483-494.
Blundell JE, Stubbs RJ. Diet composition and the control of food intake in humans. En: Bray GA, Bouchard C, James WPT, eds. Handbook of obesity. New York: Marce Dekker, 1998.
Kennedy GC. The role of depot fat in the hypothalamic control of food intake in rat. Proc R Soc Lond Biol Sci,1953; 140:578-592.
Fisler JS, Egawa M, Bray GA. Peripheral 3-hydroxybutyrate and food intake in a model of dietary fat-induced obesity: effect of vagotomy. Physiol Behav, 1995; 58:1-7.
Rolls ET. Brain mechanisms underlaying flavour and apetite. Philos Trans R Soc Lond B Biol Sci 2006; 361(1471):1123-1136.
Lebowitz SE. Neurochemical-neuroendocrine system in the brain controlling macronutrient intake and metabolism. Trends Neurosci 1992; 15:491-497.
Hill AJ, Blundell JE. Macronutrients and satiety: the effects of a highcarbohydrate meal on subjective motivation to eat and food preference. Nutr Behav, 1986; 3:133-144.
Schwarts MW, Porte D. Diabetes, obesity and the brain. Science 2005; 307:375-379.
Lam TKT, Schwarts GJ, Rossetti L. Hypothalamic sensing of fatty acids. Nat Neurosci 2005; 8:579-584.
Strack AM, Sebastian RJ, Schwartz MW, Dallman MF. Glucocorticoids and insulin: reciprocal signals for energy balance. Am J Physiol, 1995; 268:R142-R149.
Tempel DL, McEwen BS, Leibowitz SF. Effects of adrenal steroid agonists on food intake and macronutrient selection. Physiol Behav, 1992; 52:1161-1166.
Tataranni PA, Larson DE, Snitker S, Young JB, Flatt JP, Ravussin E. Effects of glucocorticoids on energy metabolism and food intake in humans. Am J Physiol, 1996; 271:E317-E325.
Smith GP, Gibbs J. Satiating effect of cholecystokinin. Ann N Y Acad Sci, 1994; 713: 236-241.
Brunetti L, Michelotto B, Orlando G, Vacca M. Leptin inhibits norepinephrine and dopamine release from rat hypothalamic neuronal endings. Eur J Pharmacol,1999; 372:237-240.
De Fonseca RF, Navarro M, Gomez R, Escudero L, Nava F, Fu J, et al. An anorexic lipid mediator regulated by feeding. Nature, 2001; 414 (6860):209-212.
Cota D & Woods CS. The role of the endocannabinoid system in the regulation of energy homeostasis. Curr Opin Endocrinol Diabetes, 2005; 12: 338-351.
Pagotto U, Marsicano G, Cota D, Lutz D & Pasquali R. The emerging role of the endocannabinoid system in endocrine regulation and energy balance. Endocrine Reviews 2006; 27:73-100.
Gibbs J, Young RC, Smith GP. Cholecystokinin decreases food intake in rats. J Comp Physiol Psychol, 1973;84:488-495.
Liddle RA, Morita ET, Conrad CK, Williams JA. Regulation of gastric emptying in humans by cholecystokinin. J Clin Invest, 1986; 77:992-996.
Hayes MR, Chory FM, Gallagher CA, Covasa M. Serotonin type-3 receptor mediate cholecystokinin-induced satiation through gastric distention. Am J Physiol Integr Comp Physiol 2006; 291(1):R115-123.
West DB, Fey D, Woods SC. Cholecystokinin persistently suppresses meal size but not food intake in free-feeding rats. Am J Physiol, 1984;246: R776-R787.
Murahainen N, Kissileff HR, Derogatis AJ, Pi-Sunyer FX. Effects of cholecystokinin-octapeptide (CCK-8) on food intake and gastric emptying in man. Physiol Beba, 1988; 44:645-649.
Liu M, Shen L, Tso P. The role of enterostatin and apolipoprotein AIV on the control of food intake. Neuropeptides, 1999; 33:425-433.
Erlanson-Albertsson C, York D. Enterostatin: a peptide regulating fat intake. Obes Res, 1997; 5:360-372.Naslund E, King N, Mansten S, Adner N, Holst JJ, Gutniak M, et al. Prandial subcutaneous injection of glucagons-like peptide-1 cause weight loss in obese human subjects. Br J Nutr 2004; 91: 439-446.
Turton MD,O’Shea D, Gunn I, Beak SA, Edwards CMB, Meeran K, et al. A role for glucagon-like peptide 1 in central regulation of feeding. Nature 1996; 379:69-72.
Kreymann B, Ghatei MA, Burnet P, Williams G, Kanse S, Diani AR y cols. Characterization of glucagon-like peptide-1-(7-36) amide in the hypothalamus. Brain Res, 1989; 502:325-331.
Tang-Christensen M, Larsen PJ, Goke R, Fink-Jensen A, Jessop DS, Moller M, Sheikh SP. Central administration of GLP-1-(7-36) amide inhibits food and water intake in rats. Am J Physiol , 1996;271: R848-R856.
Egan JM, Meneilly GS, Habener JF, Elahi D. Glucagon-like peptide-1 augments insulin-mediate glucose uptake in the obese state. J Clin Endocrinol Metab 2002; 87:3768-3773.
Kirchgessner AL. Orexins in the brain-gut axis. Endocrine Rev, 2002; 23:1-15.
Van Der Lely AJ, Tschop M, Heiman ML & Ghigo E. Biological, physiological, pathophysiological, and pharmacological aspects of ghrelin. Endocrine Reviews, 2004; 25:426-457.
Valera Mora ME Scarfone A,Valenza V,Calvini M, Greco AV, Gasbarini G, y Mingrone G. Ghrelin does not influence gastric emptying in obese subjects. Obes Res 2005; 13(4):739-744.
Milke Garcia MdelP. Ghrelin: beyond hunger regulation. Rev Gastroenterol Mex 2005; 70(4):465-474.
Tschop M, Weyer C, Tataranni PA, Devanarayan V, Ravussin E, Heiman Ml. Circulating ghrelin levels are decreased in human obesity. Diabetes 2001:50:707-709.
Pritchard LE, Turnbull AV & White A. Pro-opiomelanocortin processing in the hypothalamus: impact on melanocortin signaling and obesity. J Endocrinol, 2002; 172:411-421.
Kristensen P, Martin EJ, Thim L, Ribel U, et al. Hypotalamic CART is a new anorectic peptide regulated by leptin. Nature, 1998; 393:72-76.
Thim L, Nielsen P, et al. Purification and characterization of a new hypothalamic satiety peptide, cocaine and amphetamine regulated transcript (CART), produced in yeast. FEBS Letters, 1998; 428:263-268.
Challis BG, Yeo GSH, Farooqi S, et al. The CART Gene and Human Obesity. Diabetes, 2000; 49(5):872-875.
Okumura, Toshikatu; Yamada, Hiroto; Motomura, Wataru; Khogo, Yutaka. Cocaine-Amphetamine-Regulated Transcript (CART) acts in the central nervous system to inhibit gastric acid secretion via brain corticotrpin-releasing factor system. Endocrinology, 2000; 14(8):2854-2860.
Friedman J M, Halaas J L. Leptin and the regulation of body weight in mammals. Nature. 1998; 395:763–70.
Flier J S.What’s in a name? In search of leptin’s physiologic role. J Clin Endocrinol Metab. 1998; 83:1407–13.
Mohamed-Ali V, Coppack S W. Adipose tissue as an endocrine and paracrine organ. Int J Obesity. 1998; 22:1145–58.
Abhiram S. Minireview: A hypothalamic role in energy balance with special emphasis on leptin. Endocrinology.2004; 145: 2613–20.
Frank A.J.L. Scheer, Christopher J. Morris, Steven A. Shea. The Internal Circadian Clock Increases Hunger and Appetite in the Evening Independent of Food Intake and Other Behaviors. Obesity (Silver Spring). 2013 Mar; 21(3): 421–423.
Mela DJ1.Determinants of food choice: relationships with obesity and weight control. Obes Res. 2001 Nov;9 Suppl 4:249S-255S.
Bellisle F. Assessing various aspects of the motivation to eat that can affect food intake and body weight control. Encephale. 2009 Apr;35(2):182-5.
de Castro JM, Lilenfeld LR. Influence of heredity on dietary restraint, disinhibition, and perceived hunger in humans. Nutrition. 2005 Apr; 21(4):446-55.
Susana Peciña, Kyle S. Smith. Hedonic and motivational roles of opioids in food reward: Implications for overeating disorders. Pharmacology Biochemistry and Behavior. Volume 97, Issue 1, November 2010, Pages 34-46
John Cassel. Social and Cultural Implications of Food and Food Habits. Am J Public Health Nations Health. 1957 Jun; 47(6): 732–740.
Factores ambientales tan diversos como la luz, la temperatura o el ciclo lunar influyen en estos ritmos y pueden modificarlos pero sin duda alguna el objeto que más actúa en contra o mejor dicho se impone sobre el ritmo circadiano de hambre y saciedad es el reloj. Nos hemos fijado un esquema de comidas obligados por motivos laborales o compromisos sociales, comiendo porque lo dice el reloj y no porque realmente sintamos que necesitamos hacerlo. De este modo, las necesidades energéticas pasan a un segundo plano y dejan de actuar como principal regulador del hambre, con lo que este papel recae en el horario, que no tiene porqué guardar relación con el resto de ritmos biológicos de nuestro cuerpo.
- Disponibilidad de alimentos y "comer por placer"
Frente a los animales que viven en libertad y que dependen de los alimentos que puedan encontrar en su hábitat, los humanos tenemos la posibilidad de elegir qué comer y cuándo hacerlo. La gran disponibilidad de alimentos permite que nos guiemos por otros muchos aspectos a lo hora de seleccionar qué comida pondremos en nuestro plato. Podemos elegir los alimentos en función de lo que hayamos aprendido sobre sus características saludables o perjudiciales, sus propiedades organolépticas, el cocinado y presentación de las receta, nuestra forma física e incluso componentes hereditarios. El día a día de cualquier persona puede convertirse en un auténtico "buffet libre" donde el límite de lo que puedas comer únicamente está en lo que puedas imaginar... o pagar.
Esto hace que podamos permitirnos el lujo de "comer por placer" en lugar de comer porque es necesario. Comer puede convertirse en una afición (y es perfectamente sano disfrutar con la comida), pero se ha demostrado que los circuitos neuronales implicados en el deseo de comer por necesidad son distintos a los circuitos encargados de comer porque deseamos saborear cierta comida con la disfrutamos. Esto no constituiría ningún problema, pues si ambas vías se encuentran separadas anatómica y funcionalmente, podemos desarrollar ambas conductas en función de la situación sin que se produzcan interferencias en ambas. El conflicto surge cuando la vía del placer se impone, bien silenciando la auténtica necesidad de comer o bien provocando que seleccionemos los alimentos únicamente en función de nuestros gustos, y aún siendo conscientes de que una comida en concreto no aporta todo lo que necesitamos preferimos comerla, saciando nuestra hambre "placentera" sin satisfacer nuestra hambre "fisiológica".
- Importancia de la tradición a la hora de alimentarnos
Resulta un hecho indudable que distintas poblaciones presentan hábitos de alimentación muy diferentes entre sí. En algunos casos, las pautas que rigen las dietas de estas poblaciones han sido heredadas de generaciones ancestrales y se mantienen parecidas a ellas en mayor o menor medida. En este sentido juega un papel importante la disponibilidad de alimentos que es propia y característica de cada hábitat, pues resulta lógico pensar que la dieta de nuestros antepasados se diseñara en función de los alimentos más abundantes en el área en cuestión. Las actitudes, creencias y prácticas que subyacen a estos patrones de alimentación pueden estar profundamente arraigados en algunas sociedades y grupos sociales, de modo que la tradición en cuanto a la forma de comer de un cierto colectivo forma parte de sus características distintivas y supone un factor de gran importancia a la hora de determinar cómo un individuo percibe la comida y desarrolla ciertas preferencias hacia algunos alimentos. De este modo, un plato que en un determinado país o región es considerado un manjar en otra región distinta puede ser percibido como algo desagradable y nada apetecible.
- Educación y promoción de hábitos de alimentación saludables
La posible relación entre la alimentación y la enfermedad resulta de gran interés, aunque no siempre se ha prestado a este aspecto la atención que se merece. Hace relativamente poco que se ha empezado a estudiar directamente el rol que determinadas pautas de alimentación pudieran tener en la génesis de distintas patologías, si bien los estudios realizados, a tenor de la situación actual, no parecen estar arrojando resultados de gran utilidad.
Ahora bien, aunque es cierto que de forma global la población ha adquirido ciertas nociones básicas sobre qué alimentos son más saludables y puede identificar aquellos que no lo son tanto, cualquiera puede elegir ignorarlos dejándose guiar por otros aspectos que, sin duda alguna, representan un mayor peso. Por otro lado, no todas las recomendaciones nutricionales actuales son lo efectivas que debieran ser, y muchos aspectos clásicos están actualmente en tela de juicio. Ciertos debates generan confusión y arrojan a la población mensajes contradictorios, no quedando del todo claro cuál es la dieta más saludable o que permita prevenir enfermedades. En consecuencia, la promoción de hábitos de vida saludable pierde poder como factor a tener en cuenta y no va a tener un gran impacto sobre la percepción que tenemos sobre la comida
Dejamos por hoy este tema, que continuaré en la siguiente entrada comentando el papel de los aspectos psicológicos en los ritmos de hambre y saciedad y cómo recuperar los mecanismos que nos permitan alimentarnos de forma saludable.
Bibliografía
Schwartz MW, Woods SC, Porte DJ, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature, 2000; 404(6778):661-671.De Araujo IE, Gutierrez R, Oliveira-Maia AJ, Pereira AJr, Nicolelis MA, Simon SA. Neural ensemble coding of satiety states. Neuron 2006; 51(4): 483-494.
Blundell JE, Stubbs RJ. Diet composition and the control of food intake in humans. En: Bray GA, Bouchard C, James WPT, eds. Handbook of obesity. New York: Marce Dekker, 1998.
Kennedy GC. The role of depot fat in the hypothalamic control of food intake in rat. Proc R Soc Lond Biol Sci,1953; 140:578-592.
Fisler JS, Egawa M, Bray GA. Peripheral 3-hydroxybutyrate and food intake in a model of dietary fat-induced obesity: effect of vagotomy. Physiol Behav, 1995; 58:1-7.
Rolls ET. Brain mechanisms underlaying flavour and apetite. Philos Trans R Soc Lond B Biol Sci 2006; 361(1471):1123-1136.
Lebowitz SE. Neurochemical-neuroendocrine system in the brain controlling macronutrient intake and metabolism. Trends Neurosci 1992; 15:491-497.
Hill AJ, Blundell JE. Macronutrients and satiety: the effects of a highcarbohydrate meal on subjective motivation to eat and food preference. Nutr Behav, 1986; 3:133-144.
Schwarts MW, Porte D. Diabetes, obesity and the brain. Science 2005; 307:375-379.
Lam TKT, Schwarts GJ, Rossetti L. Hypothalamic sensing of fatty acids. Nat Neurosci 2005; 8:579-584.
Strack AM, Sebastian RJ, Schwartz MW, Dallman MF. Glucocorticoids and insulin: reciprocal signals for energy balance. Am J Physiol, 1995; 268:R142-R149.
Tempel DL, McEwen BS, Leibowitz SF. Effects of adrenal steroid agonists on food intake and macronutrient selection. Physiol Behav, 1992; 52:1161-1166.
Tataranni PA, Larson DE, Snitker S, Young JB, Flatt JP, Ravussin E. Effects of glucocorticoids on energy metabolism and food intake in humans. Am J Physiol, 1996; 271:E317-E325.
Smith GP, Gibbs J. Satiating effect of cholecystokinin. Ann N Y Acad Sci, 1994; 713: 236-241.
Brunetti L, Michelotto B, Orlando G, Vacca M. Leptin inhibits norepinephrine and dopamine release from rat hypothalamic neuronal endings. Eur J Pharmacol,1999; 372:237-240.
De Fonseca RF, Navarro M, Gomez R, Escudero L, Nava F, Fu J, et al. An anorexic lipid mediator regulated by feeding. Nature, 2001; 414 (6860):209-212.
Cota D & Woods CS. The role of the endocannabinoid system in the regulation of energy homeostasis. Curr Opin Endocrinol Diabetes, 2005; 12: 338-351.
Pagotto U, Marsicano G, Cota D, Lutz D & Pasquali R. The emerging role of the endocannabinoid system in endocrine regulation and energy balance. Endocrine Reviews 2006; 27:73-100.
Gibbs J, Young RC, Smith GP. Cholecystokinin decreases food intake in rats. J Comp Physiol Psychol, 1973;84:488-495.
Liddle RA, Morita ET, Conrad CK, Williams JA. Regulation of gastric emptying in humans by cholecystokinin. J Clin Invest, 1986; 77:992-996.
Hayes MR, Chory FM, Gallagher CA, Covasa M. Serotonin type-3 receptor mediate cholecystokinin-induced satiation through gastric distention. Am J Physiol Integr Comp Physiol 2006; 291(1):R115-123.
West DB, Fey D, Woods SC. Cholecystokinin persistently suppresses meal size but not food intake in free-feeding rats. Am J Physiol, 1984;246: R776-R787.
Murahainen N, Kissileff HR, Derogatis AJ, Pi-Sunyer FX. Effects of cholecystokinin-octapeptide (CCK-8) on food intake and gastric emptying in man. Physiol Beba, 1988; 44:645-649.
Liu M, Shen L, Tso P. The role of enterostatin and apolipoprotein AIV on the control of food intake. Neuropeptides, 1999; 33:425-433.
Erlanson-Albertsson C, York D. Enterostatin: a peptide regulating fat intake. Obes Res, 1997; 5:360-372.Naslund E, King N, Mansten S, Adner N, Holst JJ, Gutniak M, et al. Prandial subcutaneous injection of glucagons-like peptide-1 cause weight loss in obese human subjects. Br J Nutr 2004; 91: 439-446.
Turton MD,O’Shea D, Gunn I, Beak SA, Edwards CMB, Meeran K, et al. A role for glucagon-like peptide 1 in central regulation of feeding. Nature 1996; 379:69-72.
Kreymann B, Ghatei MA, Burnet P, Williams G, Kanse S, Diani AR y cols. Characterization of glucagon-like peptide-1-(7-36) amide in the hypothalamus. Brain Res, 1989; 502:325-331.
Tang-Christensen M, Larsen PJ, Goke R, Fink-Jensen A, Jessop DS, Moller M, Sheikh SP. Central administration of GLP-1-(7-36) amide inhibits food and water intake in rats. Am J Physiol , 1996;271: R848-R856.
Egan JM, Meneilly GS, Habener JF, Elahi D. Glucagon-like peptide-1 augments insulin-mediate glucose uptake in the obese state. J Clin Endocrinol Metab 2002; 87:3768-3773.
Kirchgessner AL. Orexins in the brain-gut axis. Endocrine Rev, 2002; 23:1-15.
Van Der Lely AJ, Tschop M, Heiman ML & Ghigo E. Biological, physiological, pathophysiological, and pharmacological aspects of ghrelin. Endocrine Reviews, 2004; 25:426-457.
Valera Mora ME Scarfone A,Valenza V,Calvini M, Greco AV, Gasbarini G, y Mingrone G. Ghrelin does not influence gastric emptying in obese subjects. Obes Res 2005; 13(4):739-744.
Milke Garcia MdelP. Ghrelin: beyond hunger regulation. Rev Gastroenterol Mex 2005; 70(4):465-474.
Tschop M, Weyer C, Tataranni PA, Devanarayan V, Ravussin E, Heiman Ml. Circulating ghrelin levels are decreased in human obesity. Diabetes 2001:50:707-709.
Pritchard LE, Turnbull AV & White A. Pro-opiomelanocortin processing in the hypothalamus: impact on melanocortin signaling and obesity. J Endocrinol, 2002; 172:411-421.
Kristensen P, Martin EJ, Thim L, Ribel U, et al. Hypotalamic CART is a new anorectic peptide regulated by leptin. Nature, 1998; 393:72-76.
Thim L, Nielsen P, et al. Purification and characterization of a new hypothalamic satiety peptide, cocaine and amphetamine regulated transcript (CART), produced in yeast. FEBS Letters, 1998; 428:263-268.
Challis BG, Yeo GSH, Farooqi S, et al. The CART Gene and Human Obesity. Diabetes, 2000; 49(5):872-875.
Okumura, Toshikatu; Yamada, Hiroto; Motomura, Wataru; Khogo, Yutaka. Cocaine-Amphetamine-Regulated Transcript (CART) acts in the central nervous system to inhibit gastric acid secretion via brain corticotrpin-releasing factor system. Endocrinology, 2000; 14(8):2854-2860.
Friedman J M, Halaas J L. Leptin and the regulation of body weight in mammals. Nature. 1998; 395:763–70.
Flier J S.What’s in a name? In search of leptin’s physiologic role. J Clin Endocrinol Metab. 1998; 83:1407–13.
Mohamed-Ali V, Coppack S W. Adipose tissue as an endocrine and paracrine organ. Int J Obesity. 1998; 22:1145–58.
Abhiram S. Minireview: A hypothalamic role in energy balance with special emphasis on leptin. Endocrinology.2004; 145: 2613–20.
Frank A.J.L. Scheer, Christopher J. Morris, Steven A. Shea. The Internal Circadian Clock Increases Hunger and Appetite in the Evening Independent of Food Intake and Other Behaviors. Obesity (Silver Spring). 2013 Mar; 21(3): 421–423.
Mela DJ1.Determinants of food choice: relationships with obesity and weight control. Obes Res. 2001 Nov;9 Suppl 4:249S-255S.
Bellisle F. Assessing various aspects of the motivation to eat that can affect food intake and body weight control. Encephale. 2009 Apr;35(2):182-5.
de Castro JM, Lilenfeld LR. Influence of heredity on dietary restraint, disinhibition, and perceived hunger in humans. Nutrition. 2005 Apr; 21(4):446-55.
Susana Peciña, Kyle S. Smith. Hedonic and motivational roles of opioids in food reward: Implications for overeating disorders. Pharmacology Biochemistry and Behavior. Volume 97, Issue 1, November 2010, Pages 34-46
John Cassel. Social and Cultural Implications of Food and Food Habits. Am J Public Health Nations Health. 1957 Jun; 47(6): 732–740.






Enhorabuena. Muy currado si señor!!!
ResponderEliminarGracias! Me alegro de que te haya gustado.
Eliminarbuen articulo, si señor!!! esperando con ganas la segunda parte....
ResponderEliminarGracias! Ya estoy trabajando en esa segunda parte, aunque va para largo.
EliminarBuenos días, me surge una duda. En los alimentos envasados tipo salchichas, panceta... casi todos vienen con fécula de patata, azucares... aunque sea en pequeñas cantidades sacaría de la cetosis?
ResponderEliminarHola Anónimo
EliminarContestando directamente a tu pregunta te diré que pequeñas cantidades de cualquier hidrato de carbono que no sobrepase el límite ideal de 0,5 gr por kilo de peso no te va a sacar de la cetosis. A pesar de esto en los momentos posteriores al entrenamiento podríamos sobrepasar ese límite por la mayor sensibilidad del músculo a los carbohidratos. Tampoco tienen el mismo efecto los carbohidratos en función de con qué los comemos; así por ejemplo una cucharadita de azúcar en ayunas te puede provocar un pico de insulina que interrumpa la cetosis, mientras que cierta cantidad de hidratos dentro de una gran comida que tarde más en digerirse y llegar a sangre no afectan tanto.
De todas maneras, si me lo permites, te aconsejo no abusar de ningún producto con azúcares añadidos. El consumo de azúcar en exceso nos hace "dependientes" y debemos evitarlo para ganar salud.
buenas Ignacio!! Que opinión tienes sobre la dieta anabólica? con ciclos de carga 1-2 a la semana haciéndolos cuando quieras. Gracias.
ResponderEliminarsolo en cuanto a la ganancia de músculo.
EliminarMe gustan bastante las dietas cíclicas, que combinan días altos y bajos en hidratos. Fomentan la flexibilidad metabólica, maximizando tanto la utilización de grasas como de hidratos de carbono. Yo llevo mucho tiempo siguiendo este tipo de dietas, empecé con la cetogénica cíclica de Lyle Macdonald y ahora sigo otro enfoque un poco más personalizado.
EliminarQuizás el único inconveniente que le veo a esta dieta es que en los días altos en hidratos la cantidad de grasas es muy alta y la de proteínas muy baja; yo bajaría grasas hasta 10-15% y subiría proteínas hasta un 30% más o menos.
Gracias de nuevo por contestar a mis preguntas. Soy nuevo en esto y perdona si me pongo pesado.
Eliminarllevo ahora mismo una semana de ketoadaptación, con doce días es suficiente?
Cuando pueda meter el día de recarga, lo haré conforme dices, pero sin tocar calorías verdad? solo modificando %.
Gracias.
David, lee mi entrada sobre keto-adaptación. Verás que lo mínimo que se necesita para una adaptación plena es un periodo de 4 a 6 semanas; durante ese tiempo no se deben introducir hidratos de carbono por encima del límite ideal de 0,5 gr por kilo de peso (solo procedentes de verduras y frutos rojos).
ResponderEliminarNo dudes en preguntarme lo que necesites.
Ayer me hice la prueba con las tiras de interacetona y di positivo en cetosis. Pero esta mañana, me la he vuelto ha hacer y me salia totalmente el blanco. No pasé de los 28 g HC, si como algo de nueces y almedras. Pero muy poco. Es normal? o me debería salir tb en cetosis compliendo mis macros.
ResponderEliminarCíñete a tus macros y no te preocupes mucho de las tiras. Puedes haber salido de cetosis en un momento puntual o que la concentración de cuerpos cetónicos en orina sea muy pequeña. Irás comprobando, conforme te vayas keto-adaptando, que las tiras dejan de ser representativas del estado de cetosis y llegado un momento ya no marcan.
EliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarentonces, en cuanto las tiras ya no marquen, es porque estoy ketoadaptado?
ResponderEliminarEl problema de las tiras es que arrojan resultados muy variables entre personas. Depende de la cantidad de beta-hidroxibutirato que estés produciendo dejarás de marcar antes o después. Lo lógico sería que tras un par de semanas marcando en las tiras, una reducción de la intensidad indique que estés próximo a la keto-adaptación, pero la única forma exacta de estar en cetosis es ceñirte a los macros.
EliminarUn artículo de 10! Estoy realizando el TFG en BCC sobre la influencia del efecto "I cooked myself" en la ingesta, emociones y saciedad; y he de decir que tu articulo me ha ayudado bastante!
ResponderEliminarMuchas gracias campeón! Sigue así!
¡Hola! No sabes cuánto me alegra tu comentario. Siempre es un placer servir de ayuda a alguien. Espero que te salga muy bien tu TFG. Un abrazo.
EliminarHola que tal... Me gustó mucho tu trabajo, y me sirvió para la clase de Anatomía. Saludos.
ResponderEliminar